Rydbergs formel
I dagens värld har Rydbergs formel blivit ett ämne för ständigt intresse och debatt. Oavsett om det beror på dess påverkan på samhället, på arbetsplatsen, i politiken eller i människors personliga liv, är Rydbergs formel ett element som inte går obemärkt förbi idag. När världen utvecklas och omständigheterna förändras, blir Rydbergs formel allt mer relevant och dess inflytande märks i alla aspekter av det dagliga livet. I den här artikeln kommer vi att grundligt utforska rollen och betydelsen av Rydbergs formel, analysera dess olika aspekter och hur det påverkar samhället som helhet.
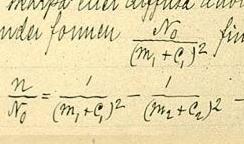
Rydbergs formel upptäcktes 1888 av fysikern Janne Rydberg för att beräkna spektrallinjer från atomer. Han hade upptäckt en regelbundenhet i vågtalen av spektralserier som kunde skrivas som
där λ är det utstrålade ljusets våglängd, m och n är heltal sådana att m>n och och är tal mindre än 1 som är specifika för en viss serie. är en universell konstant, som nu kallas Rydbergs konstant.
För väte gäller att konstanterna . Med det ena heltalet lika med 2, ger Rydbergs formel Balmerserien, en formel från 1885 som Rydberg inte hade känt till.
För lätta atomer finns det små avvikelser från den universella konstanten, och man kan skriva
där är elektronmassan, är atomkärnans massa. är Rydbergs konstant för oändlig massa (1,097 373 156 85 · 107 m-1) och R h c = 13,606 eV.
Rydbergs formel och konstantens värde kan enkelt förklaras med Bohrs atommodell, i vilken den potentiella energin för det n:e elektronskalet (det som ligger närmast kärnan har n=1) kan skrivas
är Plancks konstant, är ljusets hastighet och är atomnumret. Eftersom frekvensen ν för ljus är relaterat till energin genom E=hν och våglängden är relaterat till frekvensen genom kan man lätt se att Rydbergs formel uttrycker energiskillnaden mellan två skal uttryckt i våglängd.
Rydbergs formel för väte med fixt n ger en olika så kallade serier av övergångar:
| n | Serie | Våglängdsområde |
|---|---|---|
| 1 | Lymanserien | ultraviolett |
| 2 | Balmerserien | synligt ljus |
| 3 | Paschenserien | infrarött |
| 4 | Brackettserien | infrarött |
| 5 | Pfundserien | infrarött |
| 6 | Humphreyserien | infrarött |
Historik
1888 hade Rydberg upptäckt en formel som beskrev förhållandet mellan våglängderna i alkalimetallernas spektra, varvid Balmerserien föll ut som ett specialfall. Även om man senare upptäckte att Rydbergs formel inte ger exakt rätt svar för andra atomer än väte, så anses den fortfarande tillräckligt noggrann för väte och för atomer bland alkalimetallerna där en enda valenselektron befinner sig på långt avstånd från de övriga. 1906 började Lyman analysera den serie av vätes spektrallinjer i det ultravioletta området som man redan visste fanns och som sedan fick sitt namn efter honom.
Rydberg förenklade sina beräkningar genom att använda vågtalet (antalet vågor i en viss längdenhet) som sitt mätetal. Han plottade vågtalen för successiva linjer i varje serie mot på varandra följande heltal som motsvarade linjernas ordning i respektive serie. När han märkte att de resulterande kurvorna alla hade samma form, försökte ha finna en enkel funktion ur vilken alla serier kunde beräknas när rätt parametrar valts.
Källor
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, tidigare version.
Fotnoter
- ^ ”Rydberg constant”. 2006 CODATA recommended values. NIST. http://physics.nist.gov/cgi-bin/cuu/Value?ryd.
- ^ ”Rydberg constant times hc in eV”. 2006 CODATA recommended values. NIST. http://physics.nist.gov/cgi-bin/cuu/Value?rydhcev.













