Transaminering
I dagens värld har Transaminering blivit ett ämne av stor relevans och intresse för ett brett spektrum av individer. Oavsett om det är ur vetenskaplig, social, kulturell eller historisk synvinkel, har Transaminering avsevärt påverkat hur människor uppfattar och förstår världen omkring dem. I den här artikeln kommer vi att utforska de olika aspekterna och dimensionerna av Transaminering, och ta upp både dess positiva aspekter och dess utmaningar, för att bättre förstå dess räckvidd och inflytande i dagens samhälle.
Transaminering är en biokemisk process, där en aminogrupp överförs från en aminosyra till en ketosyraanalog. Det är en reversibel reaktion. Denna väg är orsak till deamineringen av de flesta aminosyror. Detta är en av de viktigaste nedbrytningsvägarna som omvandlar essentiella aminosyror till icke-essentiella aminosyror (aminosyror som kan syntetiseras de novo av organismen).
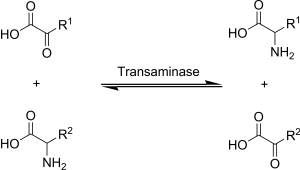
Transaminering i biokemi åstadkoms av enzymer som kallas transaminaser eller aminotransferaser. α-ketoglutarat fungerar som den dominerande aminogruppsacceptorn och producerar glutamat som den nya aminosyran.
Glutamats aminogrupp överförs i sin tur till oxaloacetat i en andra transamineringsreaktion som ger aspartat.
I cytoplasman processeras även aminosyror. Nedbrytningen innebär att aminogruppen avlägsnas från α-kolatomen. I transamineringen sker detta genom att aminogruppen från aminosyran övergår till en ketosyra, som innehåller både en karbonyl- och karboxylgrupp. Om det däremot finns överskott av aminosyror hanteras det av kroppen genom att aminogruppen tas bort och bildar ammoniak. Vilket därefter tillsätts koldioxid i ureacykeln och utsöndras med urinen som urea.
Verkningsmekanism
Transaminering katalyserad av aminotransferas sker i två steg. I det första steget överförs α-aminogruppen i en aminosyra till enzymet, vilket producerar motsvarande α-ketosyra och det aminerade enzymet. Under det andra steget överförs aminogruppen till ketosyraacceptorn och bildar aminosyraprodukten samtidigt som enzymet regenereras. Kiraliteten hos en aminosyra bestäms under transaminering. För att reaktionen ska fullbordas kräver aminotransferaser deltagande av aldehydinnehållande koenzym, pyridoxal-5'-fosfat (PLP), ett derivat av pyridoxin (vitamin B6). Aminogruppen upptas genom omvandling av detta koenzym till pyridoxamin-5'-fosfat (PMP). PLP är kovalent bunden till enzymet via en Schiff-basbindning bildad genom kondensation av dess aldehydgrupp med e-aminogruppen i en enzymatisk Lys-rest. Schiff-basen, som är konjugerad till enzymets pyridiniumring, är fokus för koenzymaktiviteten.

Ping Pong Bi Bi-mekanism för PLP-beroende enzymkatalyserad transaminering. Aminotransferasreaktionen sker i två steg bestående av tre steg: Transimination, Tautomerisering och Hydolys. I det första steget överförs α -aminogruppen i aminosyran till PLP vilket ger en α-ketosyra och PMP. I det andra steget av reaktionen, där aminogruppen av PMP överförs till en annan α-ketosyra för att ge en ny α-aminosyra och PLP.
Produkten av transamineringsreaktioner beror på tillgängligheten av α-ketosyror. Produkterna är vanligtvis antingen alanin, aspartat eller glutamat, eftersom deras motsvarande α-ketosyror produceras genom metabolism av bränslen. Eftersom lysin, prolin och treonin är en viktig nedbrytande aminosyraväg, är de enda tre aminosyrorna som inte alltid genomgår transaminering och som snarare använder respektive dehydrogenas.
Alternativ mekanism
En andra typ av transamineringsreaktion kan beskrivas som en nukleofil substitution av en amin- eller amidanjon på ett amin- eller ammoniumsalt. Till exempel kan attacken av en primär amin av en primär amidanjon användas för att framställa sekundära aminer:
- RNH2 + R'NH− → RR'NH + NH2−
- Symmetriska sekundära aminer kan framställas med användning av Raneynickel (2RNH2 → R2NH + NH3). Slutligen kan kvartära ammoniumsalter dealkyleras med etanolamin:
- R4N+ + NH2CH2CH2OH → R3N + RN+H2CH2CH2OH
Aminonaftalener genomgår också transamineringar.
Typer av aminotransferas
Transaminering medieras av flera typer av aminotransferasenzymer. Ett aminotransferas kan vara specifikt för en individuell aminosyra, eller så kan det bearbeta vilken som helst medlem av en grupp av liknande sådana, till exempel de grenkedjiga aminosyrorna, som innefattar valin, isoleucin och leucin. De två vanliga typerna av aminotransferaser är alaninaminotransferas (ALT) och aspartataminotransferas (AST) .
Se även
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, 10 maj 2024.
- Smith, M. B. and March, J. Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th ed. Wiley, 2001, p. 503. ISBN 0-471-58589-0
- Gerald Booth "Naphthalene Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_009
Noter
- ^ Booth, Gerald (2000-01-01). ”Naphthalene Derivatives”. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. doi:. ISBN 9783527306732
Externa länkar
 Wikimedia Commons har media som rör Transaminering.
Wikimedia Commons har media som rör Transaminering.- Amino Acid Biosynthesis Arkiverad 2017-04-26
- The chemical logic behind aminoacid degradation and the urea cycle
