Perklorat
I den här artikeln kommer ämnet Perklorat och allt det omfattar att utforskas på djupet. Från dess ursprung till dess inverkan idag kommer varje relevant aspekt kring Perklorat att analyseras i detalj. Olika perspektiv, teorier och tillvägagångssätt kommer att undersökas som gör att läsaren kan få en heltäckande förståelse för Perklorat. Dessutom kommer data, statistik och konkreta exempel att presenteras som stöd för de argument som presenteras. Den här artikeln syftar till att ge en komplett och berikande syn på Perklorat, och uppmuntra läsaren att reflektera och bilda sig en egen uppfattning om det.
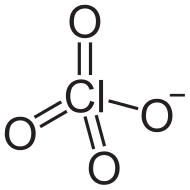

Perklorater är salter av perklorsyra och innehåller perkloratjonen ClO4–.
Egenskaper
Perklorater är oxiderande, men är inte lika reaktiva som klorider, klorater eller hypokloriter. Detta är lite av en paradox då kloratomen i perklorat har oxidationstillstånd +7. Det är extremt högt och perklorat har också en hög redoxpotential. Men tack vare elektronerna från de fyra syreatomerna har kloratomen fullt valensskal, vilket gör den ovillig att ingå i en redox-reaktion.
Användning
Att perklorater är stabila trots att de är starkt oxiderande har gjort att de har funnit många användningsområden som till exempel som raketbränsle, i facklor, i drivladdningar till airbags, i kemiska syregeneratorer m.m.
Inom medicin används perklorater för att behandla giftstruma. Perklorat begränsar sköldkörtelns förmåga att ta upp jod och hämmar produktionen av tyroxin.